课题组在《Cell》杂志公开全球首个新冠病毒全病毒精细结构
北京时间 2020 年 9 月 15 日,李赛课题组和李兰娟院士课题组紧密合作,利用冷冻电镜断层成像和子断层平均重构技术成功解析的新冠病毒(SARS-CoV-2)全病毒三维结构在国际权威学术期刊《细胞》杂志上发表。
“3 千多万人感染,过百万人死亡。但罪魁祸首新型冠状病毒却仍是“看不见的敌人”。在新冠肺炎的“大流行”面前,警醒公众、疫情防控宣传甚至开发疫苗抗体等工作都离不开对新冠病毒真实模样的清晰认识。
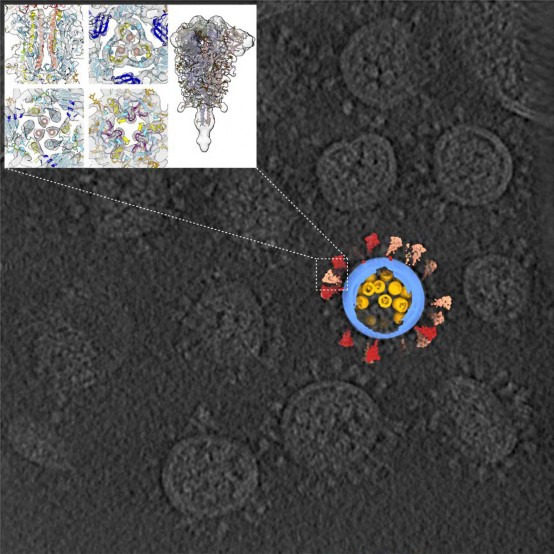
在这项研究中,清华团队在生物安全二级实验室中对浙大团队提供的含有灭活新冠病毒的细胞培养液进行提纯浓缩,使用实验室开发的高通量、高分辨冷冻电镜断层成像技术
(cryo-ET),从所采集的 100TB 数据中筛选出 2294 颗病毒颗粒(目前已知的关于新冠病毒最大的 cryo-ET 数据集),并重构出一颗具有代表性的完整的病毒三维结构,分辨率达 7.8-
11Å。
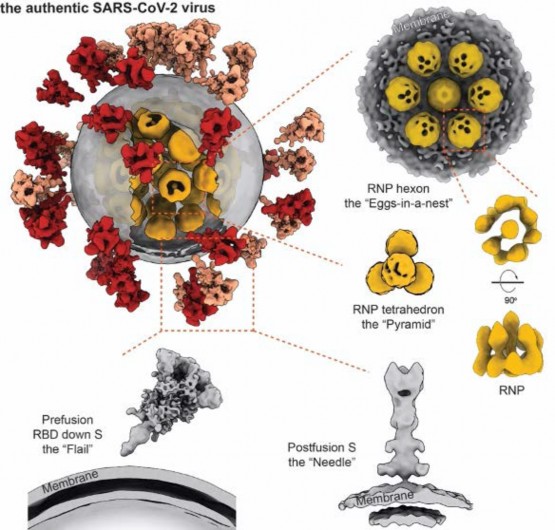
平均直径约 80 纳米,表面约有 30 个刺突蛋白,内部约有 30 个核糖核蛋白复合物的真实病毒三维图像让“看不见的敌人”清晰地展现在世人面前,首次让世界看到新冠病毒全病毒结构。这一成果对疫苗及抗体研发、疫情防控宣传、科普教育等均有重要意义。其中一位审稿人在评审意见里称赞道:“这项工作展示了迄今为止我所见过的最完整新冠病毒形象,这也是使用冷冻电镜断层成像方法解析完整颗粒结构的一次绝妙的应用……”。法国科学院院士、著名结构病毒学家 Felix A. Rey 教授来信祝贺道:“这是一个里程碑式的工作”。
成果公开以来,被国内多家主要媒体报道,获得张伯礼、施一公、李兰娟等院士点赞!,截止 9 月 16 日,总阅读量近 9000 万,一度排名当日微博热搜前十名,单条新闻 300 万阅读量,数万点赞及评论。该项研究工作也受到包括纽约时报、BBC、CellPress 细胞出版社新闻部在内的众多国外媒体及记者咨询,希望获得关于该全病毒结构的更多信息。
原位下的刺突蛋白结构
新冠病毒的“皇冠”得名于它表面的刺突蛋白,它是其侵入人体细胞的“钥匙”,目前大多数疫苗和抗体的研发均聚焦于该蛋白。
该研究解析出处于融合前状态及融合后状态的三种不同构象刺突蛋白结构。结果表明,刺突蛋白在病毒表面呈随机分布,且可自由摆动,类似于古代武器“链锤”,这种灵活的特性有利于“钥匙”及时调整方向,同细胞上更多的“锁”(受体)结合而增加侵染细胞几率。刺突蛋白也很脆弱,灭活和提纯方式不当可能导致其部分、甚至完全脱落,产生不正常的“秃”病毒。
刺突蛋白表面有多达 66 个糖基化修饰,这些糖像盾牌一样保护病毒不被免疫识别。此前未有对病毒上天然状态下糖基化修饰的详细研究。在清华大学蛋白质化学与组学平台的帮助下,该问题得到详细解答:相比于重组刺突蛋白,原位的糖基更大也更复杂,但总体而言相似性较大,这种相似性保证了重组刺突蛋白研发疫苗工作的有效性。
核糖核蛋白复合物天然结构
在庞大数据的支撑下,李赛课题组对病毒内近 20,000 颗核糖核蛋白复合物(RNP)进行了挑选和分析。开创性地展示了病毒腔内核糖核蛋白复合物结构及组装机制。该复合物像串珠一样将 RNA 组织在一起,并在病毒体内呈现六聚“鸟巢”型和正四面体“金字塔”型两种局部排列,有序地收纳了 RNA 这根“长绳”,还增加了病毒在复杂环境中经受物理挑战的能力。这是世界范围内首次“看清”正义单链 RNA 病毒的内部结构。
李赛课题组
李赛研究员课题组从 2018 年建立至今才短短两年,能在三个月内完成这一世界级重大成果,得益于合作者李兰娟院士团队高质量的样品供应,也源自他十多年如一日坚持在囊膜病毒研究领域,并深耕于冷冻电镜断层成像技术的开发,是国内难得的既熟悉囊膜病毒,又拥有先进冷冻电镜断层成像技术的青年科学家。疫情攻关期间,他亲自带学生做实验、解结构,推进项目迅速完成。他常教育自己的学生:作为病毒科研工作者,既要有在太平时期‘甘坐冷板凳’的决心,也要有在重大疫情期间挺身而出的勇气!
李赛研究员(清华大学)为本文的第一通讯作者(lead contact),李兰娟院士(浙江大学)为本文的共同通讯作者。姚航平(浙江大学)、宋雨桐(清华大学博士生)、陈勇(清华大学博士后)、吴南屏(浙江大学)、徐家璐(清华大学博士生)为并列第一作者。另外,李赛课题组的孙楚杰,张佳星,张哲源也参与了该工作。同时,该项工作得到了多位结构及病毒学专家的大力协助,包括清华大学施一公院士、英国南安普顿大学 Max Crispin 教授、清华大学雷建林博士。项目的顺利开展,离不开王宏伟教授、颜宁教授、王新泉教授、张林琦教授、丁强教授、李雪明教授的支持和讨论。特别感谢清华大学冷冻电镜平台,生物计算平台,蛋白质化学与组学平台的支持。研究工作得到了清华大学人才启动经费,北京高精尖结构生物学创新中心,清华-北大生命联合中心的支持。